ESTRUCTURA DEL BENCENO DE KEKULÉ
A mediados del siglo XIX, se sabía que el benceno era insaturado, con una formula C6H6, la cual requería cuatro dobles enlaces, anillos o una combinación de ambas cosas. Además se sabía que no experimenta reacciones características de alquenos, como por ejemplo, cuando se le hace reaccionar lentamente con bromo en presencia de hierro, se formara un producto de sustitución C6H5Br, en vez del grupo C66H4Br2, que es el de adición, y no se producían otros isómeros distintos.
Basándose en estos resultados, Augus Kekulé propuso en 1865 que el benceno consiste en un anillo de carbonos y que puede formularse como un 1,3,5-ciclohexatrieno, y esto explicaba la formación de un solo sustituyente del monobromado.
El problema partía en el dibromado, ya que existían cuatro isómeros, dos 1,2-dibromociclohexatrieno, uno 1,3-dibromociclohexatrieno y uno 1,4-dibromociclohexatrieno. Esto lo explicó Kekulé diciendo que los dobles enlaces se mueven con gran rapidez, con lo cual los bromos no pueden separarse.
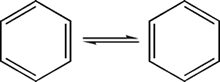
El movimiento de los enlaces ocurre velozmente.
Teoría de resonancia
Como Kekulé dijo el benceno presenta dos posibles estructuras equivalentes en la cual cada enlace carbono - carbono es en promedio 1,5 enlaces; el valor medio entre el doble y el sencillo.
A continuación se verá los cuatro postulados de la teoría de resonancia del benceno y de los hidrocarburos aromáticos:
- Las estructuras resonantes son imaginarias, no reales. La estructura del benceno es un híbrido que no cambia, único, en el que se combinan ambas formas de resonancia.
- Las estructuras resonantes difieren solo en las exposiciones de sus electrones. Ni la posición, ni la hibridación de los átomos cambia de una estructura de resonancia a otra. En el benceno los seis núcleos de carbono forman un hexágono regular, mientras que los electrones Pi son compartidos por igual entre los núcleos vecinos, cada enlace carbono - carbono tiene un promedio de 1,5 electrones, y todos los enlaces son equivalentes.
- Las distintas formas de resonancia no tienen que ser equivalentes. Sin embargo mientras más equivalentes sean las formas, tanto más estable será la molécula. Así el benceno con dos formas de resonancia equivalentes, es muy estable.
- Tanto más estructuras de resonancia haya, tanto más estable será la molécula.
(Química Orgánica McMurray, Paginas 508-509).
Se puede concluir, entonces, que la estructura del benceno es única y no oscila entre dos estructuras de Kekulé; pero por convención se dice que el benceno toma una de las estructuras resonantes, para mayor facilidad de trabajo con su estructura en forma escrita. Cabe destacar que cualquiera de las estructuras de Kekulé que se tomen serán en consecuencia equivalentes.
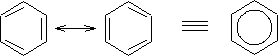
Estabilidad del benceno
El benceno no representa el comportamiento característico de los alquenos. Por ejemplo no reacciona con permanganato de potasio para formar productos de ruptura, ni con ácido acuoso para generar alcoholes y tampoco con HCl gaseoso para producir halogenuros de alquilo. Además no experimente reacciones de adición electrofílica.
Se puede tener una idea de la estabilidad del benceno examinando los calores de hidrogenación. El ciclo hexeno tiene una variación de 28 Kcal/mol; el 1,3-ciclo hexadieno, alcanza una variación de 55,4 Kcal/mol, Se puede desprender de esto que el valor para el segundo es poco menos del doble del valor que para el primero.
Continuando con la analogía, se advierte que para el ciclo hexatrieno(benceno), debiera ser de tres veces el valor del ciclo hexeno, 86 kcal/mol. El valor real para el ciclo hexatrieno es de 49,8 kcal/mol, casi 36 Kcal/mol de estabilidad extra.
Continuando con la analogía, se advierte que para el ciclo hexatrieno(benceno), debiera ser de tres veces el valor del ciclo hexeno, 86 kcal/mol. El valor real para el ciclo hexatrieno es de 49,8 kcal/mol, casi 36 Kcal/mol de estabilidad extra.
Otra prueba de la estabilidad poco usual del benceno se debe a la longitud de sus enlaces. Los enlaces sencillos carbono - carbono, tienen una longitud de 1,54 Aº , y los de los dobles normales, es de 1,34 Aº , en el benceno la longitud de enlace es de 1,39 Aº.
Aromaticidad y regla 4n + 2 de Hückel
Según el científico Alemán Erich Hückel, una molécula será aromática si tiene un sistema monociclo planar, con un orbital P en cada átomo y solo si el sistema de orbitales P contiene 4n + 2 electrones Pi donde n es un numero entero (0,1,2,3,4...), es decir las moléculas que contienen 2,6,14,18,... Electrones Pi pueden ser aromáticas. Las moléculas que contienen 4n electrones Pi (4,8,12,16...) no pueden ser aromáticas aunque sean cíclicas y conjugadas.
Naftaleno y policiclos aromáticos
Aunque la regla de Hückel se aplica solo a los compuestos aromáticos monociclos; el concepto de aromaticidad puede extenderse más allá formando los llamados compuestos aromáticos policíclicos. El más simple de estos es el Naftaleno, con dos anillos bencenoides unidos lado a lado. Posee tres estructuras de Kekulé, es decir, tres formas de resonancia. Así como el benceno es una forma intermedia entre sus fases de resonancia, el naftaleno y todos los compuestos aromáticos policíclicos también son un punto intermedio entre sus fases de resonancia.
Entre los compuestos aromáticos policíclicos se encuentran: el Naftaleno, Antraceno, Fenantreno, Benzo(a)pireno, Coroneno, etc
REACCIONES DE SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA
La reacción más importante de los compuestos aromáticos es la sustitución electrofílica aromática. Esto es, un electrófilo (E+) reacciona con un anillo aromático y sustituye uno de los hidrógenos.
Mediante este tipo de reacción es posible anexar distintos sustituyentes al anillo aromático. Se le puede Halogenar (sustituir con halógeno: -F, -Cl, -I, -Br, -At), Nitrar (sustituir por un grupo nitro: -NO2), Sulfonar (sustituir por un grupo ácido sulfonico -SO3H), Alquilar (sustituir por un grupo alquilo: -R), etc.
Todas estas reacciones pueden ser llevadas a cabo seleccionando los reactivos y condiciones apropiadas.
Todas estas reacciones pueden ser llevadas a cabo seleccionando los reactivos y condiciones apropiadas.
Halogenacion:
a) Bromación de anillos aromáticos: Se hacen reaccionar los anillos aromáticos con bromo, con FeBr3 como catalizador dando como resultado bromobenceno como producto de sustitución.
b) Cloración y Yodación: El cloro y el yodo pueden introducirse en el anillo aromático mediante una reacción electrofilica en las condiciones apropiadas. Los anillos aromáticos reaccionan en presencia de FeCl3 como catalizador, para producir clorobencenos.
El yodo por si mismo no reacciona con los anillos aromáticos y se necesita un promotor para que efectúe adecuadamente la reacción. Los mejores promotores son los oxidantes como el peróxido de hidrogeno H2O2, o sales de cobre como CuCl2. Estos promotores actúan oxidando el yodo, convirtiéndola en una empresa electrófila más potente que reacciona como si fuera I+. Entonces el anillo aromático ataca el I+, con lo que forma un producto de sustitución normal.
Nitración Aromática:
Los anillos se pueden nitrar con una mezcla de ácido nítrico y ácido sulfúrico concentrados. Se piensa que el electrofílo es el ion nitronio, NO2+, que se genera del ácido nítrico, por protonacion y perdida de agua. Este ion genera un carbocatión intermediario, cuando este pierde un protón se genera el nitrobenceno como producto de sustitución.
Este proceso es realmente importante para la industria de explosivos, pigmentos y farmacia.
Nitrobenceno
Sulfonacion aromática:
Los anillos aromáticos pueden sulfonarse por reacción con ácido sulfúrico fumante (H2SO4 + SO3). El electrófilo reactivo es HSO3+ o SO3, dependiendo de las condiciones de reacción.
Este proceso ocurre similar a la bromación y nitración pero tiene la característica de que es reversible.
Esta reacción tiene importancia en la elaboración de colorantes y productos farmacéuticos.
Este proceso ocurre similar a la bromación y nitración pero tiene la característica de que es reversible.
Esta reacción tiene importancia en la elaboración de colorantes y productos farmacéuticos.
Alquilación de anillos aromáticos:
Reacción de Friedel-Crafts: Es una sustitución electrofilica aromática en la cual el anillo ataca un carbocation electrofilo. Este carbocatión se genera cuando el catalizador AlCl3, ayuda al halogenuro de alquilo a ionizarse. La reacción finaliza con la perdida de un protón.
Esta reacción posee tres limitaciones fundamentales:
Esta reacción posee tres limitaciones fundamentales:
- Solo se pueden usar halogenuros de alquilo.
- La reacción es ineficaz cuando los anillos aromáticos se encuentran unidos a grupos fuertemente desactivadores.
- Es difícil controlar él numero de alquilaciones que se desea producir.
- Pueden producirse transformaciones e el esqueleto del grupo alquilo. (pueden anexarse un n-propil o un i-propil).
Fenoles y alcoholes aromáticos. Quinonas:
Los fenoles son compuestos aromáticos que contienen un grupo hidroxilo unido directamente al núcleo. El más simple de los fenoles es el hidroxi derivado del benceno llamado fenol o ácido carboxilico.
Fenol
Los fenoles se sintetizan por fusión de sulfonatos con álcalis, por descomposición de sales de diazonio en condiciones adecuadas, tratando los derivados halogenados de los hidrocarburos bencenoicos con soluciones de álcalis a altas temperaturas.
Cresoles:
Son los homólogos más cercanos al fenol, también se les conoce como hidrixitoluenos, se obtienen del alquitrán de hulla. El p-cresol es uno de los compuestos de putrefacción de las proteínas y posee al igual que los fenoles un gran poder bactericida por lo que se le usa en medicina y veterinaria.
Fenoles dihidroxilicos:
Los más simples son los derivados del benceno y se conocen tres isómeros de este p-dihidroxibenceno (hidroquinona), m-dihidroxibenceno(resorcina) y o-dihidroxibenceno(pirocatequina).
La hidroquinona se emplea como revelador fotográfico; la resorcina se emplea para fabricar plásticos, colorantes y sustancias medicinales.
La hidroquinona se emplea como revelador fotográfico; la resorcina se emplea para fabricar plásticos, colorantes y sustancias medicinales.
Quinonas:
Al oxidarse la hidroquinona, se forma la quinona. Esta molécula posee la estructura de un hexadieno unido a 2 oxigenos en forma para-.
Se utiliza para la fabricación de muchos colorantes.
Se utiliza para la fabricación de muchos colorantes.
Fenoles trihidroxilicos:
Existen tres trihidroxibencenos posibles: 1,2,3- trihidroxibenceno(pirogalol);1,3,5-trihidroxibenceno(floroglucina) y 1,2,4-trihidroxibenceno (hidroxihidroquinona); todas son sustancias cristalinas. El pirogalol se obtiene calentando ácido galico y despresiandose el dióxido de carbono y el contenido de oxigeno en mezclas gaseosas.
La floroglucina (floroglucinol), se obtiene al fundir potasa cáustica con resinas vegetales.
La floroglucina (floroglucinol), se obtiene al fundir potasa cáustica con resinas vegetales.
Eteres aromáticos: Estos se pueden dividir en dos grupos: a) del tipo Ar-o-Ar.
b) Eteres del tipo Ar-o-R, es decir, uno de sus radicales pertenece a la serie alifatica y el otro a la aromática y se pueden obtener de dos maneras: El primero es tratando los derivados halogenados de los hidrocarburos con fenatos. El segundo es más fácil y menos costoso, se logra tratando el dimetilsulfato con fenoles en un medio alcalino.
b) Eteres del tipo Ar-o-R, es decir, uno de sus radicales pertenece a la serie alifatica y el otro a la aromática y se pueden obtener de dos maneras: El primero es tratando los derivados halogenados de los hidrocarburos con fenatos. El segundo es más fácil y menos costoso, se logra tratando el dimetilsulfato con fenoles en un medio alcalino.
Aldehídos aromáticos: El más simple es el benzaldehído C6H5-CHO. Se conoce también como esencia de almendras amargas, pues en la naturaleza se encuentra en dichos frutos.
Industrialmente el benzaldehido se obtiene a partir del tolueno, el cual debe haber sido clorado con anterioridad. El primer producto de la cloración es el cloruro de bencilo C6H5CH2Cl, el que en la cloración posterior pasa a cloruro de bencilidenoC6H5CHCl2. Al calentarlo en agua con pequeñas cantidades de hidróxido calsico o ácido sulfúrico, se forma benzaldehído.
Otro método de obtención es la oxidación directa de tolueno, haciéndose pasar a altas temperaturas sus vapores mezclados con aire, a través de un tubo catalizador (oxido férrico).
Industrialmente el benzaldehido se obtiene a partir del tolueno, el cual debe haber sido clorado con anterioridad. El primer producto de la cloración es el cloruro de bencilo C6H5CH2Cl, el que en la cloración posterior pasa a cloruro de bencilidenoC6H5CHCl2. Al calentarlo en agua con pequeñas cantidades de hidróxido calsico o ácido sulfúrico, se forma benzaldehído.
Otro método de obtención es la oxidación directa de tolueno, haciéndose pasar a altas temperaturas sus vapores mezclados con aire, a través de un tubo catalizador (oxido férrico).
Cetonas aromáticas: Pueden ser de dos formas: diaril - cetonas o aril - alquil cetonas, es decir parte de la cetona puede contener un radical alifático o alquílico.
Pueden ser sintetizadas por método de Friedel-Crafts, tratando con cloruros de ácidos los hidrocarburos aromáticos en presencia de cloruro de aluminio.
Pueden ser sintetizadas por método de Friedel-Crafts, tratando con cloruros de ácidos los hidrocarburos aromáticos en presencia de cloruro de aluminio.
Aminas aromáticas: La más simple es la fenilamina o aminobenceno, C6H5-NH2 llamada anilina.
Existen muchos derivados de aminas aromáticas y son de gran uso industrial, entre ellos tenemos los tres isómeros de la toluidina(o-, m-, p-). Los de la nitroanilina (o-, m-, p-), las aminas secundarias etc.
Existen muchos derivados de aminas aromáticas y son de gran uso industrial, entre ellos tenemos los tres isómeros de la toluidina(o-, m-, p-). Los de la nitroanilina (o-, m-, p-), las aminas secundarias etc.
ALGUNOS VÍDEOS ADICIONALES
ORIENTACIÓN EN LA SAE

EJEMPLO 1

EJEMPLO 2
INFORMACIÓN ADICIONAL SOBRE S.A.E
16 Sustitución electrofílica aromática_omarambibenceno-estructura ORGANICA3
REACCIONES DE SUSTITUCIÓN NUCLEOFÍLICA AROMÁTICA
Información útil en el siguiente enlace:http://www.itescam.edu.mx/principal/sylabus/fpdb/recursos/r55282.PDF
No hay comentarios:
Publicar un comentario